恒瑞创新药瑞拉芙普-α联合法米替尼治疗晚期胆胰肿瘤研究登上《自然》子刊STTT
近日,由复旦大学附属肿瘤医院孟志强/解婧教授团队开展的一项“评估瑞拉芙普-α注射液(SHR-1701)联合法米替尼治疗经标准治疗失败的晚期胆道癌和胰腺癌的疗效和安全性的II期试验”在线发表于《自然》(Nature)杂志子刊、国际知名医学期刊《信号转导与靶向治疗》(Signal Transduction and Targeted Therapy)(STTT,IF:40.8)。该研究结果显示[1],SHR-1701联合法米替尼在既往经过标准治疗失败的晚期胆道系统肿瘤(BTC)或胰腺导管腺癌(PDAC)患者中,表现出令人鼓舞的疗效且安全性整体可控。
研究文章发表于《Signal Transduction and Targeted Therapy》
01
研究背景
晚期BTC和PDAC的后线治疗选择有限,患者预后差。瑞拉芙普-α注射液(SHR701)是恒瑞医药自主研发的一种抗PD-L1(程序性死亡-配体1)/TGF-βRII(转化生长因子β受体II)双功能融合蛋白,其用于胃及胃食管结合部腺癌一线治疗的上市许可申请已获国家药监局受理。该产品能够通过特异性阻断PD 1/PD-L1的相互作用,同时中和肿瘤微环境中的TGF-β信号,经研究发现阻断TGF-β信号可显著提高PD-1/PD-L1抗体的治疗效果,克服免疫治疗耐药[2-3]。SHR-1701在晚期实体肿瘤中亦表现出令人鼓舞的抗肿瘤活性和可接受的安全性,包括铂基方案后复发或转移性宫颈癌、以及胃癌等[4-6]。法米替尼是恒瑞医药自主研发的一种口服的多靶点酪氨酸激酶抑制剂,对c-Kit、VEGFR1/2/3、PDGFRα/β、FGFR2/3、Ret、Axl、Mer、Flt3和Fms等激酶均有明显的抑制作用[7],属于多靶点抗血管生成靶向药。
基于SHR-1701和法米替尼的联合作用机制,以及TGF-β激活、免疫耗竭和血管内皮生长因子A(VEGFA)上调之间的重叠特性,联合治疗可能会产生协同抗肿瘤效应并改善患者的临床预后。
02
研究设计
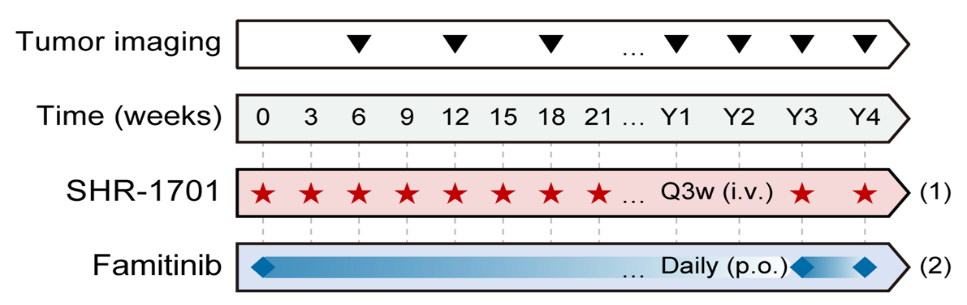
本研究是一项单中心、前瞻性、多队列的Ⅱ期探索性临床研究,旨在评估SHR-1701联合法米替尼治疗经标准治疗失败的晚期胆道癌和胰腺癌的疗效和安全性。受试者接受SHR-1701(30mg/kg q3w)和法米替尼(20mg qd,不耐受可调整至15mg qd)联合治疗,直至疾病进展或不耐受。主要研究终点为客观缓解率(ORR),次要研究终点包括疾病控制率(DCR)、无进展生存期(PFS)、总生存期(OS)及生物标志物探索等。
图1:研究设计
03
研究结果
1
临床疗效
2020年9月至2023年4月期间,共纳入27例BTC患者和24例PDAC患者。BTC队列:25例可评估的患者中ORR为28%(95%CI: 12.1-49.4),包含2例完全缓解(CR)和5例部分缓解(PR);DCR为80%(95%CI: 59.3-93.2)。PDAC队列:20例可评估的患者中ORR为15%(95% CI: 3.2-37.9),包含2例CR和1例PR;DCR为60.0% (95% CI: 36.1-80.9)。
图2:最佳总体疗效
截止2024年5月1日,中位随访时间为26.4个月(95%CI 19.6-33.2)。BTC队列中位PFS为5.1个月(95% CI:2.6-7.6),中位OS达到16个月(95% CI:6.1-NE)。PDAC队列中位PFS为2.1个月 (95% CI:0.7-3.5),中位OS为5.3个月(95% CI:4.0-6.5)。
图3:无进展生存期和总生存期的K-M曲线
2
安全性
SHR701联合法米替尼在晚期胆胰肿瘤治疗研究中,毒性总体安全可控。
3
生物标志物探索
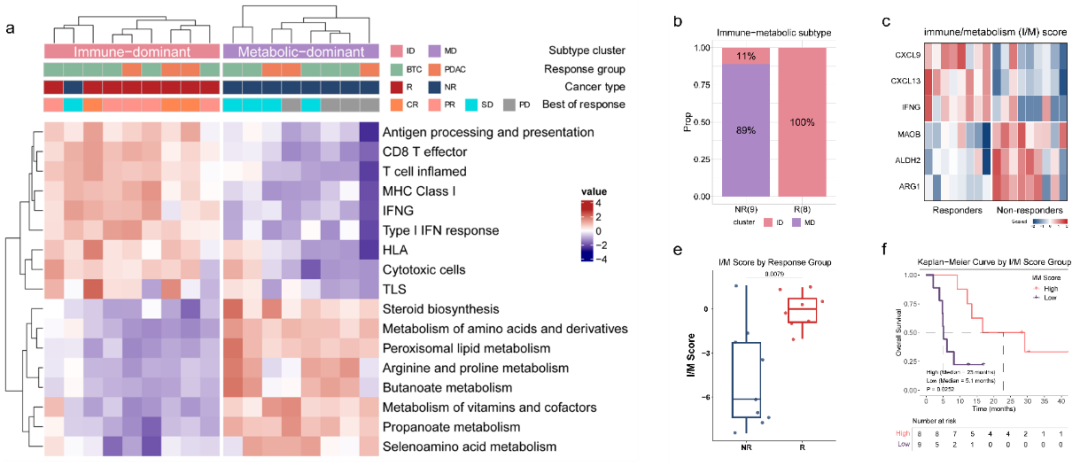
此外,探索性分析表明,原发性肿瘤切除史、外周血免疫表型变化和独特的免疫-代谢谱特征与治疗获益相关。团队基于转录组6个基因开发了一种免疫/代谢评分模型,可在多个队列中预测免疫治疗疗效,以指导筛选最有可能从该治疗方案中获益的患者。
图4:免疫/代谢谱评分模型探索
04
研究总结
该研究是"PD-L1/TGF-β/血管生成-三重阻断"的靶免联合方案在实体瘤的首次报道,为胆胰恶性肿瘤提供了一种潜在的新型联合治疗策略。对于未能从标准治疗中获益的患者,该联合疗法有望成为他们的后线治疗选择。